Ngày 31/03, Bộ Y tế đã có quyết định sửa đổi Điều 1 Quyết định số 3122/ QĐ-BYT ngày 28/06/2021 của Bộ trưởng Bộ Y tế phê duyệt có điều kiện vaccine cho nhu cầu cấp bách trong phòng, chống dịch bệnh Covid-19.
Theo đó, tại Điều 1 của Quyết định mới nhất này, Bộ Y tế phê duyệt có điều kiện vaccine cho nhu cầu cấp bách trong phòng, chống dịch bệnh Covid-19 theo quy định tại Điều 67 Nghị định số 54/2017/NĐ-CP ngày 08/05/2017 của Chính phủ quy định chi tiết một số điều và biện pháp thi hành Luật Dược, cụ thể:
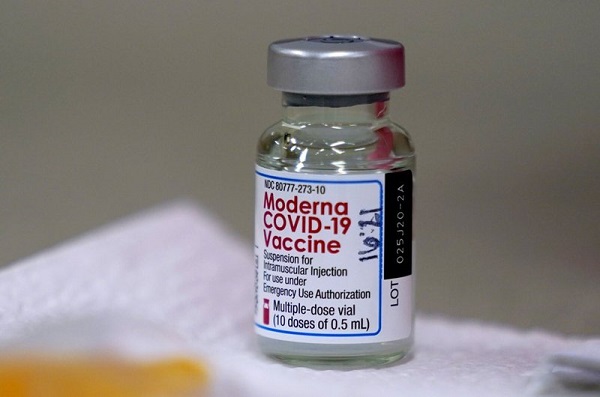
Tên vaccine: Spikevax (Tên khác là: Covid-19 Vaccine Moderna; Moderna Covid-19 Vaccine; Moderna mRNA-1273 Vaccine, Covid-19 mRNA Vaccine (nucleoside modified)).
Thành phần hoạt chất, nồng độ/hàm lượng:
Mỗi liều (0,5ml) chứa 100mcg elasomeran, vaccine Covid-19 mRNA (được bọc trong các hạt nano lipidSM-102).
Mỗi liều (0,25ml) chứa 50mcg elasomeran, vaccine Covid-19 mRNA (được bọc trong các hạt nano lipidSM-102) ( bổ sung liều này so với quyết định 3122/ QĐ-BYT ngày 28.6.2021 trước đó).
Dạng bào chế: Hỗn dịch tiêm bắp.
Quy cách đóng gói: Hộp chứa 10 lọ đa liều.
Đối với liều 0,5ml: Mỗi lọ đa liều, chứa 10 liều.
Mỗi lọ đa liều chứa tối đa là 11 liều: Trong khoảng 10 - 11 liều; Mỗi lọ đa liều chứa tối đa là 15 liều: Trong khoảng 13-15 liều (bổ sung thông tin này so với quyết định 3122/ QĐ-BYT ngày 28/06/2021 trước đó)
Đối với liều 0,25ml: Mỗi lọ đa liều, chứa tối đa 20 liều.
Tên cơ sở sản xuất - Nước sản xuất: Rovi Pharma Industrial Services, S.A - Tây Ban Nha; Recipharm Monts - Pháp; Moderna TX, Inc - Mỹ; Catalent Indiana, LLC - Mỹ; Lonza Biologics, Inc - Mỹ; Baxter - Mỹ; Moderna Biotech - Tây Ban Nha; Samsung Biologics Co., Ltd. - Hàn Quốc.
Tại quyết định mới nhất này, Bộ Y tế bãi bỏ quyết định số 3122/QĐ-BYT ngày 28/06/2021 về phê duyệt có điều kiện vaccine cho nhu cầu cấp bách trong phòng, chống dịch bệnh Covid-19.
Linh Tuệ
























