Cục Quản lý Dược vừa có công văn gửi các Sở Y tế các tỉnh, thành phố trực thuộc Trung ương về việc Cục Quản lý Dược nhận được một số thông tin liên quan đến thuốc giả, nghi ngờ giả từ Cơ quan Cảnh sát điều tra – Công an huyện Thạch Thất; Công ty TNHH AstraZeneca Việt Nam; Công ty TNHH Novartis Việt Nam; Văn phòng đại diện F.Hoffmann-La Roche Ltd tại Hà Nội, Văn phòng đại diện Les Kaboratoires Servier tại Hà Nội về việc phát hiện một số lô thuốc giả, nghi ngờ giả, không rõ nguồn gốc có thông tin ghi trên nhãn.

Các thuốc nghi ngờ giả gồm:
Nexium 40mg, Enterik Kapli Pellet Tablet, AstraZeneca, (01) 08699786040045, (21) 3500000157639358; (17) SKT: 09.2024; (10) Parti no: 22B264. Trong mỗi hộp có 04 vỉ, mỗi vỉ 07 viên. Nexium 40mg, Enterik Kapli Pellet Tablet, AstraZeneca, Số lô: 21H979, trong mỗi hộp có 04 vỉ, mỗi vỉ 07 viên.
Tetracyclin Tw3 250mg, SĐK: VD-28109-17, Số lô SX: 0321, NSX: 02/02/2021, HD: 02/02/2024, Nhà sản xuất: Công ty cổ phần dược phẩm Trung ương 3, quy cách hộp 400 viên nén.
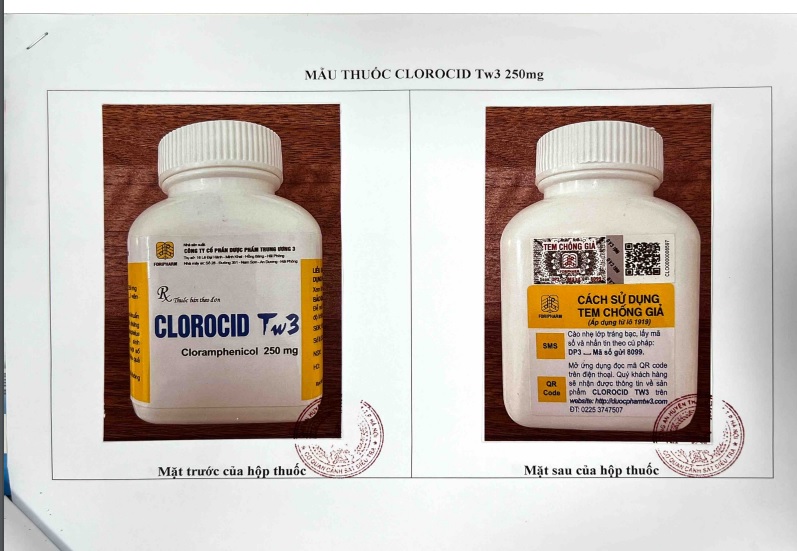
Clorocid Tw3 250mg, SĐK: VD-25305-16, Số lô SX: 0321, NSX: 07/07/2021, HD: 07/07/2024, Nhà sản xuất: Công ty cổ phần dược phẩm Trung ương 3, quy cách hộp 400 viên nén. Công ty CP Dược phẩm Trung ương 3 thông báo tới Cục Quản lý Dược từ 16/09/2019 đến 29/06/2022 (thời điểm Công ty thông báo), Công ty không tiến hành sản xuất lô thuốc nào đối với Clorocid Tw3, SĐK: VD-25305-16.
TobraDex, hộp 1 lọ đếm giọt Droptainer 5ml, số lô: 22C10HB, ngày hết hạn/EXP: 10/03/2024, ngày sản xuất/ MFD: 10/03/2022.
Diamicron MR 30mg, số lô: 695986, HSD: 09/2024; Coveram 5mg/5mg, số lô: 2170310010, HSD: 11/2024.
Để đảm bảo an toàn cho người sử dụng, Cục Quản lý Dược đã đề nghị Sở Y tế các tỉnh, thành phố trực thuộc Trung ương, Y tế các ngành thông báo cho các cơ sở kinh doanh, sử dụng thuốc không kinh doanh, phân phối và sử dụng các sản phẩm được liệt kê có các đặc điểm để phân biệt nêu trên, báo cáo cơ quan chức năng nếu phát hiện lô thuốc trên.
Tăng cường việc thanh tra, kiểm tra hoạt động kinh doanh của các cơ sở kinh doanh dược trên địa bàn, tập trung việc kiểm tra đối với các sản phẩm có thông tin như mô tả nêu trên.
Tiếp nhận và xác minh thông tin; báo cáo Ban chỉ đạo 389 tỉnh, thành phố và phối hợp với các cơ quan chức năng liên quan kiểm tra xác minh, truy tìm nguồn gốc xuất xứ đối với các sản phẩm có thông tin như mô tả nêu trên nếu phát hiện trên địa bàn. Khẩn trương tiến hành thanh tra, kiểm tra hoạt động kinh doanh thuốc đối với các cơ sở kinh doanh, sử dụng thuốc nêu trên; xử lý nghiêm các trường hợp vi phạm và báo cáo kết quả về Cục Quản lý Dược.
Yêu cầu các công ty sản xuất, kinh doanh, nhập khẩu, phân phối liên quan đến các sản phẩm có thông tin như trên cung cấp thông tin và phối hợp với Sở Y tế các tỉnh, thành phố và các cơ quan chức năng có liên quan trong việc truy tìm nguồn gốc đối với các sản phẩm.
Hải Minh
























