Mới đây, Quản lý dược - Bộ Y tế đã thông báo thu hồi, ngừng sản xuất, ngừng nhập khẩu thêm 8 loại thuốc có hoạt chất Valsartan trị huyết áp, tim mạch do sử dụng nguyên liệu bị nhiễm tạp chất có thể gây ung thư.
Theo đó, Cục Quản lý dược bổ sung thêm vào danh sách các thuốc phải thu hồi, ngừng sản xuất, ngừng nhập khẩu vì có sử dụng nguyên liệu Valsartan, gồm: Valsartan160, SĐK: VD-29714-18 (Công ty cổ phần Dược phẩm Cửu Long); Cobidan 80, SĐK: VD-22086-15 (Công ty cổ phần BV Pharma); các thuốc Meyervasid M, SĐK: VD-30052-18, Mayervas 160, SĐK: VD-26480-17, Mayervas 80, SĐK: VD-26481-17, Mayervasid, SĐK: VD-26482-17, Meyervasid F, SĐK: VD-26483-17 (Công ty Liên doanh Meyer-BPC) và thuốc Valthotan F11m Coated Tablets 160mg Standard, SĐK:VN-17592-13 (Standard Chem & Pharm Co., Ltd).
Quyết định này được đưa ra sau khi Cơ quan Quản lý dược phẩm châu Âu (EMA), Cơ quan Quản lý dược Mỹ, Cơ quan quản lý dược Đài Loan (Trung Quốc) và một số cơ quan quản lý dược khác trên thế giới công bố thêm 2 nhà sản xuất nguyên liệu valsartan chứa tạp chất N-nitrosodimethylamine (NDMA), gồm: Công ty Zhuhai Rundu Pharmaceutical Co, Ltd và Công ty Hetero Labs Ltd, sau 2 công ty đã công bố trước đó.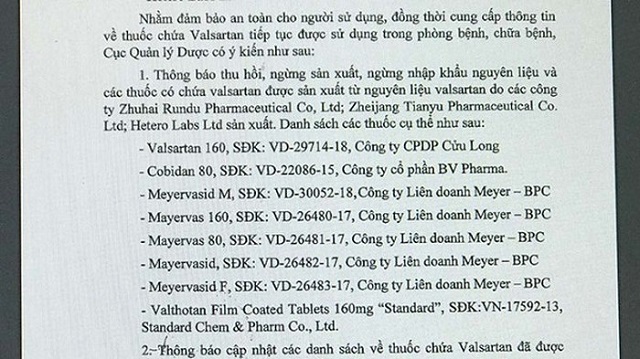
Danh sách 8 loại thuốc chứa Valsartan được Cục Quản lý dược thông báo thu hồi
Cục Quản lý dược yêu cầu các doanh nghiệp có thuốc chứa Valsartan bị định chỉ lưu hành, thu hồi nêu trên khẩn trương thu hồi toàn bộ số thuốc và báo cáo kết quả về Cục trước ngày 30-9.
Như vậy, tính đến thời điểm này, đã có 39 loại thuốc trong nước và 15 loại thuốc thành phẩm từ nước ngoài chứa hoạt chất Valsartan bị đình chỉ lưu hành và thu hồi do sử dụng nguyên liệu chứa tạp chất gây ung thư. Bên cạnh đó, có 83 loại thuốc có chứa hoạt chất Valsartan không sử dụng nguyên liệu của các công ty nói trên sẽ tiếp tục được nhập khẩu, sản xuất, lưu hành.
Trước đó, Tổ chức Y tế thế giới (WHO) thông báo về việc Cơ quan quản lý dược châu Âu (EMA), cơ quan quản lý thuốc và thực phẩm Hoa Kỳ (US FDA) và một số quốc gia khác trên thế giới đã thu hồi các thuốc chứa hoạt chất valsartan được sản xuất từ nguyên liệu valsartan của công ty Zhejiang Huahai Pharmaceuticals (Trung Quốc) do nguyên liệu này bị nhiễm tạp chất N-nitrosodimethylamine (NDMA).
Đây là tạp chất không gây nguy hại tức thời nhưng có thể gây ung thư khi sử dụng trong thời gian dài.
Tại Việt Nam, Bộ Y tế đã cấp số đăng ký lưu hành cho 111 thuốc có chứa hoạt chất valsartan; trong đó có 23 thuốc có sử dụng nguyên liệu valsartan do công ty Zhejiang Huahai Pharmaceuticals (Trung Quốc) sản xuất.
Do đó, Bộ Y tế đã có văn bản yêu cầu các cơ sở sản xuất, kinh doanh, xuất nhập khẩu ngừng ngay việc nhập khẩu, sản xuất, lưu hành, sử dụng đối với 23 thuốc có sử dụng nguyên liệu valsartan của công ty Zhejiang Huahai Pharmaceuticals (Trung Quốc) và thu hồi 23 thuốc này trong phạm vi cả nước.
Nhằm đảm bảo cung ứng đủ thuốc có chất lượng phục vụ nhu cầu điều trị và tránh biến động về giá thuốc, Bộ Y tế yêu cầu các cơ sở sản xuất, kinh doanh tiếp tục nhập khẩu, sản xuất, lưu hành 88 thuốc còn lại chứa valsartan không sử dụng nguyên liệu của công ty Zhejiang Huahai Pharmaceuticals (Trung Quốc) để thay thế cho 23 thuốc bị đình chỉ lưu hành và thu hồi.
Bộ Y tế vẫn đang tiếp tục theo dõi chặt chẽ, cập nhật thông tin từ Tổ chức Y tế thế giới, EMA, FDA và các cơ quan quản lý dược khác để kịp thời xử lý cũng như thông báo cho cán bộ y tế và người sử dụng.
Hải Đăng






















