Cụ thể, theo Quyết định số 628/QĐ-QLD ngày 31/10 do Cục Quản lý Dược, Bộ Y tế ban hành, có 14 vaccine, sinh phẩm được cấp giấy đăng ký lưu hành tại Việt Nam hiệu lực 3 năm - đợt 57.
Trong đó, có thuốc Pembroria (hoạt chất chính là Pembrolizumab, hàm lượng 100mg/4ml) do Công ty Limited Liability "PK-137" (Nga) sản xuất, được một cơ sở ở Các Tiểu Vương quốc Ả Rập Thống nhất đăng ký.
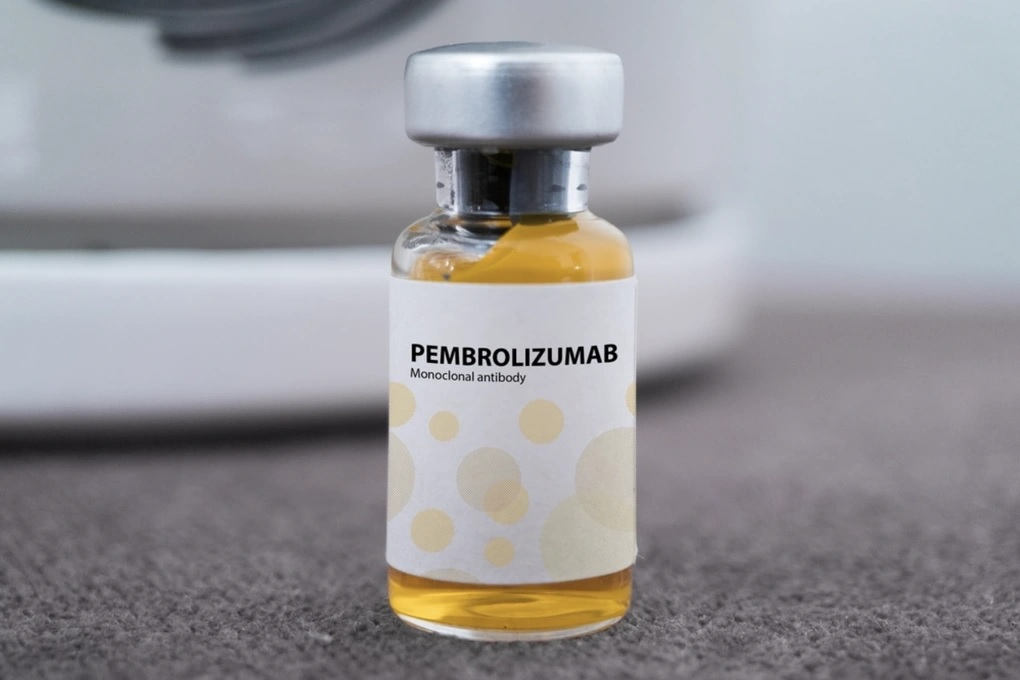
Thuốc Pembroria được bào chế dưới dạng dung dịch đậm đặc pha dung dịch tiêm truyền, có hạn sử dụng 24 tháng kể từ ngày sản xuất.
Đáng chú ý, theo thông tin từ cơ sở đăng ký lưu hành thuốc, Pembrolizumab có hơn 14 chỉ định cho các loại bệnh ung thư khác nhau (như ung thư biểu mô phổi, u hắc tố, ung thư đại trực tràng, ung thư cổ tử cung, ung thư biểu mô tế bào thận, ung thư vú...).
Trong bối cảnh nhu cầu về các thuốc ung thư tiên tiến và khả năng tiếp cận các phương pháp điều trị hiện đại cho người dân ngày càng tăng, việc Pembroria được cấp phép tại Việt Nam có ý nghĩa quan trọng.
Đức Anh