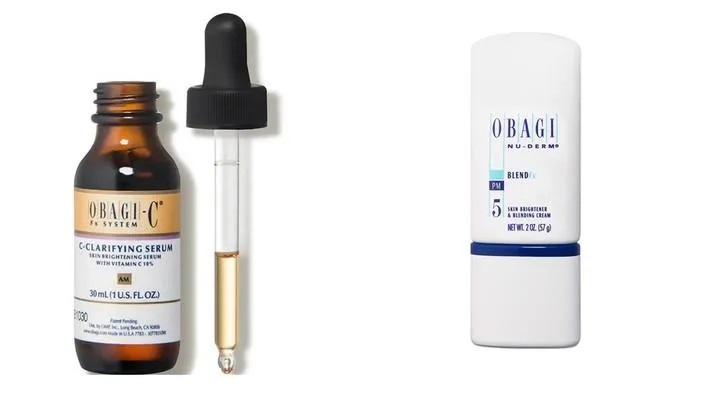
Theo đó, ngày 30/12/2024, Cục Quản lý Dược có công văn số 4200/QLD-MP thông báo thu hồi, đình chỉ lưu hành đối với lô sản phẩm Obagi-C Fx CClarifying Serum - Hộp 1 chai 30 ml. Trên nhãn ghi Số lô: 81262; NSX: 17/3/2023; HSD: 17/3/2026; do Công ty Swiss-American CDMO LLC, địa chỉ: 2055 Luna Road # 126, Carrollton, TX 75006, USA sản xuất; Tổ chức chịu trách nhiệm đưa sản phẩm ra thị trường bởi Công ty TNHH MTV thương mại xuất nhập khẩu Obagi Việt Nam, địa chỉ 12-12A Núi Thành, Phường 13, Quận Tân Bình, TP.HCM
Lý do thu hồi: Mẫu kiểm nghiệm không đạt tiêu chuẩn chất lượng (có phát hiện Hydroquinone với hàm lượng 0,027%).
Cùng ngày, Cục Quản lý Dược cũng có công văn số 4201/QLD-MP thông báo đình chỉ lưu hành, thu hồi trên toàn quốc lô sản phẩm Obagi Nu-Derm Blend Fx - Chai 57g. Trên nhãn ghi Số lô: 88011; HSD: 12/9/2026; do Công ty G.S. Cosmeceutical USA, Inc, địa chỉ: 131 Pullman Street, Livermore, CA 94551, USA sản xuất; Tổ chức chịu trách nhiệm đưa sản phẩm ra thị trường bởi Công ty TNHH một thành viên thương mại xuất nhập khẩu Obagi Việt Nam, địa chỉ: 12-12A Núi Thành, Phường 13, Quận Tân Bình, TP. HCM
Lý do thu hồi: Mẫu kiểm nghiệm không đạt tiêu chuẩn chất lượng (có phát hiện chất Hydroquinone với hàm lượng 0,019%).
Theo Phiếu công bố đã được Cục Quản lý Dược cấp cho các sản phẩm Obagi-C Fx CClarifying Serum và Obagi Nu-Derm Blend Fx, trong thành phần công thức sản phẩm kê khai trên Phiếu công bố không có thành phần Hydroquinone, nhưng có thành phần có arbutin. Theo các tài liệu khoa học về Arbutin (Tên khoa học (INCI name): 4- Hydroxyphenyl-β-D-glucopyranoside; tên khác: Beta arbutin; số CAS 497-76-7) khi hòa tan trong nước có thể bị thủy phân, tạo ra một lượng rất nhỏ hydroquinone.
Cục Quản lý Dược đề nghị Sở Y tế các tỉnh, thành phố trực thuộc Trung ương, thông báo cho các cơ sở kinh doanh, sử dụng mỹ phẩm trên địa bàn ngừng ngay việc kinh doanh, sử dụng lô sản phẩm Obagi-C Fx C-Clarifying Serum - Hộp 1 chai 30 ml và sản phẩm Obagi Nu-Derm Blend Fx - Chai 57g trả lại cơ sở cung ứng sản phẩm;
Tiến hành thu hồi lô và tiêu hủy lô sản phẩm vi phạm nêu trên; kiểm tra, giám sát các đơn vị thực hiện thông báo này; xử lý các đơn vị vi phạm theo quy định hiện hành.
Cục Quản lý dược cũng yêu cầu Công ty TNHH MTV thương mại xuất nhập khẩu Obagi Việt Nam phải gửi thông báo thu hồi tới những nơi phân phối, sử dụng lô sản phẩm ObagiC Fx C-Clarifying Serum - Hộp 1 chai 30 ml và lô sản phẩm Obagi Nu-Derm Blend Fx - Chai 57g nêu trên; tiếp nhận sản phẩm trả lại từ các cơ sở kinh doanh và tiến hành thu hồi, tiêu hủy toàn bộ lô sản phẩm không đáp ứng quy định.
Gửi báo cáo thu hồi và tiêu hủy lô sản phẩm Obagi-C Fx C-Clarifying Serum - Hộp 1 chai 30 ml và lô sản phẩm Obagi Nu-Derm Blend Fx - Chai 57g nêu trên về Cục Quản lý Dược trước ngày 10/1/2025.
Sở Y tế TP.HCM giám sát Công ty TNHH MTV thương mại xuất nhập khẩu Obagi Việt Nam trong việc thực hiện thu hồi và tiêu hủy các lô sản phẩm không đáp ứng quy định.
Hải Minh

























