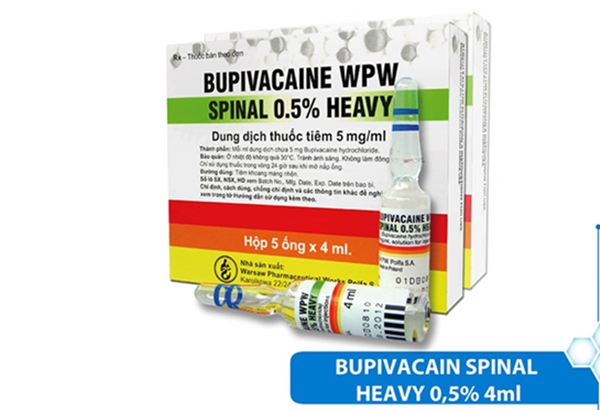
Cục Quản lý Dược yêu cầu thay thế thuốc Bupivacaine WPW Spinal Heavy 0,5%
Mới đây, Cục Quản lý Dược đã nhận được văn bản số 219/SYT-NVD của Sở Y tế Hà Nội về việc cung ứng mặt hàng Bupivacaine. Sở Y tế Hà Nội có gửi kèm văn bản số 1937/CPC1-KD ngày 21/11/2019 của công ty thông báo gửi các cơ sở y tế về việc công ty dừng xuất và đề nghị Bệnh viện tạm dừng sử dụng mặt hàng thuốc Bupivacaine WPW Spinal Heavy 0,5% (Số Giấy đăng ký lưu hành: VN-20879-17) do Công ty Warsaw Pharmaceutical Works Polfa S.A., Ba Lan sản xuất.
Liên quan đến nội dung này, Cục Quản lý Dược yêu cầu Công ty CP Dược phẩm Trung ương CPC1 khẩn trương có giải pháp thay thế thuốc Bupivacaine WPW Spinal Heavy 0,5% đã trúng thầu để đảm bảo thực hiện hợp đồng đã ký kết theo quy định của Luật Đấu thầu 2013, Nghị định số 63/2014/NĐ-CP ngày 26/06/2014 và Thông tư số 15/2019/TT-BYT ngày 11/07/2019 của Bộ Y tế và đảm bảo nhu cầu khám bệnh, chữa bệnh của nhân dân.
Bên cạnh đó, khẩn trương phối hợp với các đơn vị chức năng triển khai các nội dung theo chỉ đạo của Cục Quản lý Dược tại Công văn số 19671/QLD-ĐK và 19639/QLD-CL ngày 21/11/2019. Yêu cầu công ty gửi báo cáo bằng văn bản nội dung mục 1 về Cục Quản lý Dược trước ngày 26/11/2019.
Trước đó, tại bệnh viện phụ nữ TP. Đà Nẵng có 2 sản phụ bị tai biến nghiêm trọng sau khi áp dụng phương pháp gây tê tủy sống, nghi do thuốc gây tê Bupivacaine. Hiện, Sở Y tế TP. Đà Nẵng và Sở Y tế tỉnh Quảng Nam đã có văn bản yêu cầu tạm ngưng sử dụng loại thuốc nói trên.
Hằng Vương